Fullerene: dal Nobel per la Chimica ai lubrificanti Bardahl

Origine e storia del fullerene
Era il 1985 quando Harold Kroto dall’University of Sussex, James Heath, Robert Curl, Richard Smalley e Seán O’Brien dalla Rice University, scoprirono il fullerene C⁶⁰ e gli altri fullereni. I primi 3 ottennero poi il relativo premio Nobel per la Chimica nel 1996.
La classe di questi composti, negli anni che seguirono trovò impieghi in numerosi campi, da quello industriale a quello medicinale, fino a quello aerospaziale, nonostante il prezzo considerevole. Nel 2010, il telescopio spaziale della NASA Spitzer, individuò la loro presenza, fino a quel momento solo teorizzata, nello spazio.
Breve caratterizzazione
I fullereni rappresentano una classe di composti che deve il loro nome alla loro particolare struttura poliedrica-sferoidale.
La loro forma ricorda quella delle cupole geodetiche ideate dall’architetto e designer statunitense R. B. Fuller.
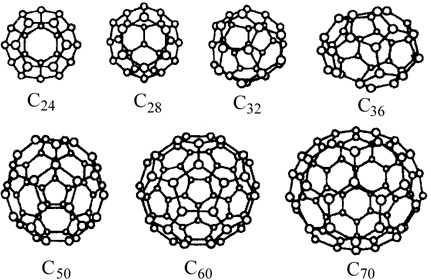
I fullereni sono poi unicamente composti da atomi di carbonio, in un numero pari compreso fra 32 e 190.
Oltre a essere presenti in natura in forma di grafite e diamante, essi costituiscono anche la terza forma allotropica del carbonio.

Chimica del fullerene
Il primo fullerene sintetizzato, il C⁶⁰ a 60 atomi di carbonio, è semplicemente denominato fullerene, al più Buckyball o Buckminsterfullerene. Si tratta letteralmente di una sfera di atomi di carbonio, ibridati sp². Geometricamente possiamo definirlo un icosaedro tronco con 32 facce, 90 spigoli e 60 vertici. Nel C⁶⁰, ogni pentagono è circondato da 5 esagoni, struttura confermata anche sperimentalmente. Il diametro della ‘gabbia’, cava come per tutti i fullereni, è pari a circa 0,7 nm. Ivi sono presenti sia legami detti 6-6, cioè quelli condivisi da 2 anelli esagonali, (più corti, e forti), sia quelli 6-5, che intercorrono fra un pentagono e un esagono.
Il numero di atomi di carbonio presenti nel fullerene è determinabile con la seguente formula: nC = (10+nE) • 2
Dove nC=numero di carboni e nE= numero di esagoni presenti
Fisso per ogni fullerene rimane il numero delle 12 maglie utili a chiudere la struttura generale.
Stabilità
Di norma i fullereni sono piuttosto stabili, fatta eccezione per quelli a minor numero di carboni. Fullereni come il C²⁰, formato esclusivamente da pentagoni, sono infatti affetti da numerose tensioni, che si generano alla chiusura della struttura, e generano instabilità. Questa instabilità spesso sfocia in isomeria e nella perdita della struttura fullerenica a favore di altre più stabili, come quella ad anello.
Reattività
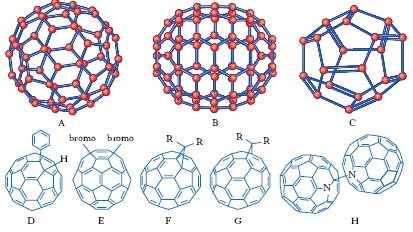
In primis abbiamo che il fullerene può formare facilmente complessi con metalli di transizione. È invece difficilmente ossidabile, ma può essere ridotto con la formazione di sali detti fulleruri. È poi reattivo nei confronti dei radicali, dei nucleofili e dei carbeni, per addizione. Da quest ultima reazione possiamo ottenere composti di rilievo come i metanofullereni, dove 1 carbonio lega 2 atomi fullerenici. In ultimo, il C⁶⁰ può essere anche facilmente idrogenato, tramite riduzione con litio in ammoniaca liquida, ottenendo il solido C⁶⁰H³⁶.
Per quanto riguarda i derivati, risaltano gli eterofullereni dove uno o più atomi fullerenici sono sostituiti con atomi diversi. Fra i più studiati i borafullereni e gli azafullereni, dove gli eteroatomi sono rispettivamente boro e azoto. Poiché questi atomi hanno un elettrone di valenza in meno del carbonio, gli eterofullereni contenenti un numero dispari di sostituzioni (per es., i comuni monoazafullereni) hanno carattere radicalico e tendono a formare dimeri.
Principali proprietà del fullerene
Normalmente il il C⁶⁰ è un isolante, ma drogandolo è possibile ribaltare totalmente la situazione. Fisicamente, il drogaggio è possibile sia col metallo che viene racchiuso nella cavità interna della struttura sferoidale, sia con l’attacco dello stesso sulla superficie esterna. Nel primo caso, otteniamo un composto endoedrico, nel secondo un composto esoedrico. Se poi il drogaggio avviene a temperature fra i 19K mediante potassio, o i 45K utilizzando tallio o rubidio, otteniamo un superconduttore.
Applicazioni tecniche nei lubrificanti: Bardhal XC C60
Bardahl è un’azienda statunitense, leader nel settore dei lubrificanti e degli additivi, in essere da più di 80 anni, molto attiva nel settore ricerca e sviluppo. Dopo anni di studi, nei laboratori Bradahl è stata messa a punto la formulazione XTC C60 che consente l’impiego del Fullerene nei lubrificanti. Le molecole di C⁶⁰ sostanzialmente si interpongono fra gli organi meccanici del motore, comportandosi come cuscinetti a sfera e riducendo notevolmente gli attriti. Motore e cambio sono così meno soggetti a usura e corrosione, guadagnando una buona fluidità d’esercizio. Nel dettaglio le molecole formano un film protettivo difficilmente intaccabile, che rende il lubrificante più longevo. Tecnicamente l’olio dovrebbe anche risultare meno in grado di produrre la cosiddetta “morchia” all’interno del motore, essendo meno degradabile del normale. In aggiunta a questa tecnologia ne sono poi state sviluppate altre, come la Bardahl Polar Plus, che sfrutta l’azione di molecole molto polari, al fine di creare una gamma 100% sintetica di lubrificanti, performante e chimicamente innovativa.

