Approfondimento caso Beirut, nitrato d’ammonio: cosa è e come si usa

Credits: Il Corriere
Le esplosioni a Beirut di ieri 4 agosto, hanno causato lo sfollamento di oltre 300mila persone e danni per minimo 3 miliardi di dollari, a quanto dichiarato dal governatore della capitale libanese, Marwan Abboud. Il bilancio morti-feriti-dispersi è attualmente di minimo 100-4000-100. La tragedia però non è conclusa, in quanto inziano a configurarsi pericoli per la salute derivanti dai fumi potenzialmente tossici. In proposito, il ministro della salute libanese Hasan, ha invitato chiunque possa a lasciare la città immediatamente. Continua poi affermando che le esalazioni delle sottilissime polveri derivanti dalle esplosioni potrebbero avere effetti anche mortali a lungo termine. Vediamo in questo articolo le principali caratteristiche del più probabile imputato: il nitrato di ammonio.
La chimica del nitrato di ammonio
Innanzitutto chiariamo che il nitrato di ammonio appartiene alla classe dei nitrati, ovvero sostanze composte da 1 atomo di azoto e 3 di ossigeno (NO³). Generalmente derivano dall’acido nitrico, e con i nitriti (NO²) sono ampiamente presenti in natura. Nello specifico, il nitrato di ammonio è un sale di colore bianco e di formula NH⁴NO³. Nella rappresentazione sottostante possiamo osservare i due ioni coinvolti:
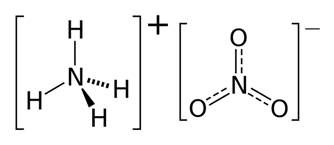
Caratteristiche fisiche
Il nitrato di ammonio ha delle peculiarità molto rilevanti, anche all’atto pratico. In primis è polimorfo. Questo significa che può assumere forme cristalline diverse, il che si traduce in strutture con diverse proprietà fisiche ma identico comportamento chimico. Le diverse modificazioni polimorfiche rappresentano infatti sempre la stessa sostanza. Un esempio comune di polimorfismo e quello del carbonio, che può darci sia la grafite sia il diamante. A questo proposito, il nitrato di ammonio presenta ben 5 strutture fisiche differenti per pressioni fino a 9×10⁸ Pa: il sistema cubico, due sistemi tetragonali, il sistema alfa-rombico, e quello beta-rombico. Ognuno di questi sistemi ha un diverso range di temperature di stabilità. Per quanto riguarda le temperature riproducibili normalmente in natura, abbiamo una transizione dalla forma beta-rombica alla alfa-rombica dopo i 32,3°C. Questa transizione si traduce nella massima variazione di volume specifico, cioè del 3,6%. Quì abbiamo il primo motivo per conservare con cura il nitrato di ammonio.
Caratteristiche chimiche
Come già anticipato, il nitrato di ammonio presenta possibili criticità anche dal punto di vista chimico. In primis ha una forte propensione ad ossidare, quindi è molto reattivo nei confronti di numerose sostanze organiche. In più, se presente allo stato fuso, tende a sciogliere metalli ed ossidi metallici, con probabilissimo decorso esplosivo. Il pericolo esplosione si configura anche in seguito ad un aumento di pressione o al contatto con superfici molto calde (>260°C). In questi casi si ha una decomposizione esplosiva, secondo la reazione: NH⁴NO³—>2NH³+3NO²+NO+N²+5H²O. Notare che da questa reazione, fra le altre cose, si generano ossidi di azoto, sostanze molto tossiche ben note parlando di smog. Un’altra reazione degna di nota è quella con acido cloridrico, che genera cloruro di ammonio e acido nitrico, altri composti molto impegnativi per quanto riguarda trasporto e stoccaggio. Anche questi rappresentano ottimi motivi per conservare il nitrato di ammonio con le dovute attenzioni.

Produzione e diffusione del nitrato di ammonio
Solitamente il nitrato di ammonio viene prodotto con una semplice e poco costosa reazione di neutralizzazione tra ammoniaca e acido nitrico: NH³(gassoso)+HNO³(gassoso) —> NH⁴NO³ (solido). Il fatto che sia relativamente facile da produrre, unitamente alla sua spiccata utilità, lo rende molto diffuso. L’azoto, trova largo impiego in agricoltura, dove è usato per arricchire il terreno, essendo fondamentale per il benessere di moltissime piante. Il nitrato di azoto in questo settore rappresenta una delle migliori fonti di azoto disponibili. Trattandosi comunque di un prodotto che necessita di qualche conoscenza preliminare, è acquistabile legalmente solo se muniti di patentino fitosanitario. Molte testate giornalistiche, oltre ad aver diffuso voci molto improbabili sul nitrato di sodio, hanno anche confuso il nitrato di ammonio con il nitrato di potassio (salnitro). Quest ultimo, trova largo impiego nell’industria dei fuochi d’artificio, (da quí la confusione) dove assieme a carbone e zolfo, è uno dei principali composti utilizzati.

Il nitrato d’ammonio nell’industria mineraria: l’ANFO
Un altro utilizzo, secondario rispetto al precedente, è quello nell’industria degli esplosivi. In edilizia è infatti molto apprezzato il cosiddetto ANFO, acronimo di Ammonium Nitrate Fuel Oil. Si tratta di una molto economica e molto poco sensibile (ovvero stabile) miscela di nitrato d’ammonio, olio minerale/gasolio e altri additivi meno significativi. L’ANFO è impiegato nell’industria estrattiva e in quella delle demolizioni civili, ma non tutti i Paesi ne fanno uso. A differenza di quanto riportato da note fonti non specializzate, l’ANFO può sì dar luogo a detonazioni ad alta potenza, ma la tal cosa non è assicurata. A causa della bassa sensibilità infatti, di norma si utilizzano booster ripetitori per constatare l’avvenuta esplosione. Anche le quantità dei reagenti debbono essere calcolate molto precisamente, in caso contrario si avrà solamente la formazione di vari gas, anche tossici, ma nessuna detonazione notevole. Nell’industria estrattiva, per ovviare a questi inconvenienti, si è soliti utilizzare l’ANFO in forma di sferette di nitrato d’ammonio imbevute direttamente nel gasolio, il che dovrebbe aumentarne la sensibilità. In questa configurazione però, l’ANFO ha comportamento igroscopico, tende quindi a perdere facilmente la sua funzione esplosiva. Come altri esplosivi, anche l’ANFO è presente in più varianti, la più chiaccherata è l’Apan.
Conclusioni
Sono state avanzate congetture anche sull’Ammonal, altro esplosivo sempre a base nitrato d’ammonio, il suo utilizzo però risale ai tempi dell’esercito Austroungarico. Veniva utilizzato per il caricamento di granate, bombe a mano e bombe da bombarda. Necessita inoltre di un innesco considerevole. Sostanzialmente, in questo clima di incertezza, sono state varate varie ipotesi sul perché e sul cosa fosse detenuto nell’hangar 12. Ultimamente una nuova fonte, di non certa attendibilità, ha anche avanzato l’ipotesi di detenzione irregolare di munizioni e\o missili. In particolare, l’opinione di Danilo Coppe, geominerario esplosivista ed esperto di blasting engineering con oltre 700 interventi di esplosivistica civile documentati, verte su questa versione. Quel che per ora è sicuro, è che non essendovi disponibilità di indagini ed analisi scientifiche accurate e concluse, non si possono avere ulteriori certezze. Le fonti che citano il nitrato d’ammonio, al momento sembrano comunque le più concrete.
