Non solo disordine, entropia ed elasticità nei polimeri

entropia
La parola entropia entra nel nostro vocabolario scientifico fin dagli anni del liceo. In genere, ci viene data una definizione un po’ superficiale che ci dice che l’entropia è una misura del grado di disordine di un sistema e che ha a che fare con il calore dissipato durante una trasformazione termodinamica.
Messe così insieme, queste due cose sembrano non essere direttamente collegate ed il motivo è che, per dare una definizione sufficientemente chiara, bisogna aspettare gli anni dell’università e studiare una materia chiamata “termodinamica statistica”. Questa ci permette di avere una visione d’insieme delle proprietà della materia come pressione, temperatura e dunque anche l’entropia.
Meccanica Statistica
Prima di procedere diamo una breve introduzione al ramo della fisica detto “meccanica statistica”.
Immaginiamo di voler studiare il comportamento di un gas. Tutte le sue proprietà macroscopiche quali pressione, temperatura, volume devono essere in qualche modo connesse con il movimento di tutte le singole particelle che compongono il gas stesso.
Il primo approccio che ci verrebbe da usare dunque è il seguente: “voglio determinare la traiettoria di ciascuna particella di questo gas, così facendo potrò ricavare ogni altra proprietà”, ma a questo punto emergono due problemi, uno di tipo computazionale ed uno di tipo fisico.
Il primo problema è che il gas, nella migliore delle ipotesi, sarà costituito da un numero di Avogadro di particelle ossia $$N_A = 6.022 \times 10^{23}.$$ Avremmo dunque bisogno di risolvere un numero esorbitante di equazioni differenziali il che richiederebbe ,anche per il miglior calcolatore esistente al giorno d’oggi, un tempo di attesa improponibile.
D’altro canto, anche nell’ipotesi che la nostra potenza di calcolo un giorno possa raggiungere queste prestazioni così elevate, resta il problema della determinazione delle condizioni iniziali che si traduce dicendo che “per determinare come si muoverà una certa particella ho bisogno di sapere la sua posizione e la sua velocità iniziali”. Attualmente, non siamo in grado di determinare per ogni particella dove esse si trovino e a che velocità esse si stiano muovendo con assoluta precisione. Tale lacuna ha come conseguenza che questo genere di approccio è dunque impraticabile.
Com’è già successo più e più volte nella storia dell’umanità, quando ci si trova danti ad un ostacolo insormontabile, si cerca un modo per aggirarlo. Ecco che in ciò interviene la meccanica statistica, che propone il seguente approccio: “Tutto sommato non ho realmente necessità di seguire i movimenti di ogni particella se il mio obiettivo sono le proprietà macroscopiche, quello che mi interessa realmente è sapere come le molecole si comportano mediamente, in altre parole è necessario un approccio statistico al problema”
Un’altra definizione di Entropia
A questo punto, la meccanica statistica ci permette di ottenere una nuova definizione dell’entropia. In primo luogo, bisogna capire che ad un determinato stato macroscopico possono corrispondere molteplici configurazioni microscopiche sia in termini di posizione delle singole molecole che in termini di velocità. Ricordiamo, infatti, che quello che ci interessa in questo caso non sono le singole molecole, ma le loro proprietà medie.
Il macrostato può essere definito come l’insieme delle condizioni macroscopiche di un sistema quali pressione, temperatura, numero di moli e volume, il microstato è invece un concetto legato al tempo.
Si può immaginare di scattare in un certo istante una foto ad un sistema che si trovi in determinate condizioni, cioè in un ben preciso macrostato. In tale istante, ognuna delle particelle del sistema ha una determinata posizione, diversa da quella che si può osservare in una seconda foto scattata nell’istante di tempo successivo anche se le condizioni macroscopiche possono essere esattamente le stesse.
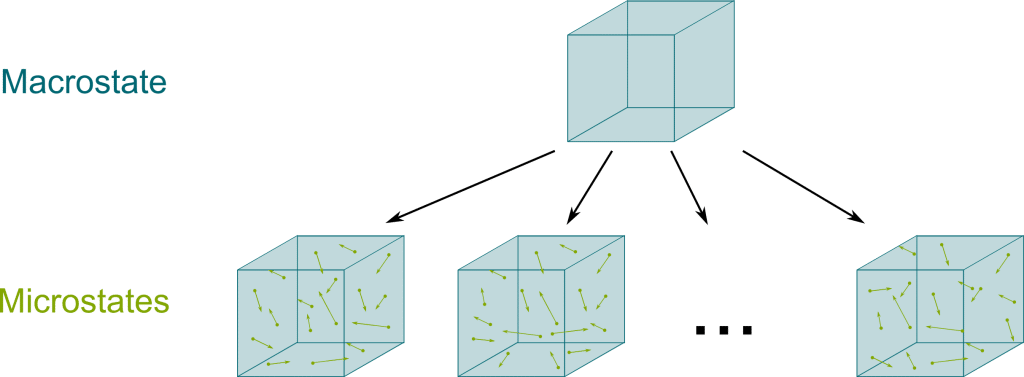
Ludwig Boltzmann definì l’entropia di un sistema come segue: $$S = K_b \ln{W}$$
Dove \(S\) rappresenta l’entropia del sistema, \(K_b\) è una costante detta costante di Boltzmann e \(W\) rappresenta il numero di stati microscopici che corrispondono ad uno stato macroscopico.
Entropia ed Elasticità nei polimeri
Confusi? È normale, l’entropia fa quest’effetto su tutti ma ancora un piccolo sforzo e saremo ripagati con una spiegazione efficace del perché le gomme sono elastiche.
Prima di procedere, ricordiamo che le gomme sono composte da polimeri ed i polimeri non sono altro che molecole estremamente lunghe composte, generalmente, da un’unità detta monomero ripetuta varie volte.
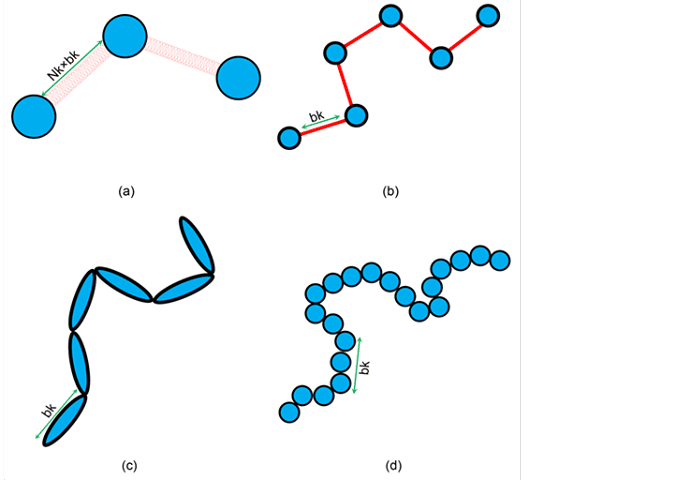
Cosa accade quando, però, il numero di monomeri diventa esageratamente alto? È necessario trattare questo sistema con la meccanica statistica. In particolare, esiste un modello, detto modello di Kuhn, che descrive un polimero come se si trattasse di una serie di bastoncelli connessi tra loro e liberi di muoversi nello spazio, la lunghezza di questi segmenti è detta lunghezza di Kuhn.
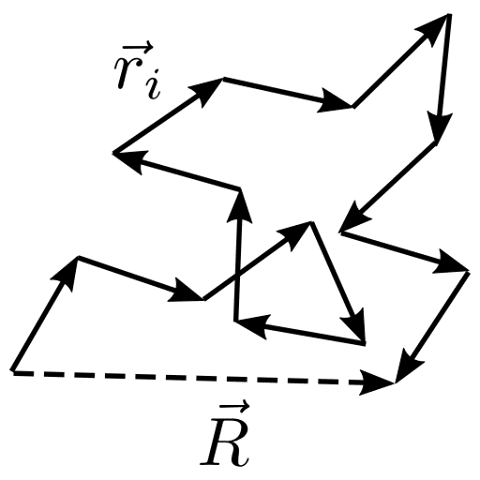
A questo punto, ci chiediamo quale sia una lunghezza utile per misurare questo polimero dato che non lo troveremo mai completamente allungato, ma sempre raggomitolato su se stesso. Possiamo usare un parametro detto “end-to-end distance” ossia la distanza tra il primo e l’ultimo segmento. Seguono poi una serie di ragionamenti abbastanza complessi da confonderci ulteriormente (ecco perché li saltiamo) per poi giungere alla fine alla seguente formula: $$\overrightarrow{F} = \, – \dfrac{K_b \, T}{n \, l^2} \,\overrightarrow{R},$$ che come possiamo notare è estremamente simile alla forza di richiamo di una molla ideale. Ma che nesso c’è con l’entropia?
Prendiamo di nuovo in considerazione l’equazione di Boltzmann, che ci permette di calcolare l’entropia di uno stato macroscopico e proviamo ad applicarla in questo caso. Ricordiamo sempre cosa ci dice il secondo principio della termodinamica ovvero: “l’entropia di un sistema isolato tende ad aumentare nel tempo fino al raggiungimento di un equilibrio termodinamico”.
Il nostro sistema, dunque, evolverà verso lo stato che rende l’entropia massima. Adesso proviamo a confrontare due casi limite, il primo nel quale il nostro polimero si presenta come un gomitolo (dunque molto aggrovigliato su se stesso) ed il secondo in cui il nostro polimero è completamente allungato e si presenta come un lungo filamento.
È evidente che, mentre per il secondo stato (polimero allungato) esista una sola configurazione corrispondete, per il primo (polimero aggrovigliato) ne esistono molteplici, avendo più microstati corrispondenti l’entropia della configurazione aggrovigliata è maggiore e dunque il sistema. Una volta che non agiscono più forze, esso tende ad accorciarsi fino a tornare ad essere una matassa simile ad un gomitolo, esattamente come una molla torna alla sua posizione di equilibrio.
Un modello semplificativo
Quello che è stato presentato nei paragrafi precedenti è il modello più “semplice” per descrivere l’elasticità dei polimeri ed è un buon modello solo per certi particolari casi e per polimeri dalla struttura semplice. In natura esistono una varietà enorme di polimeri e, quando questi diventano sufficientemente grandi, entrano in gioco altri effetti che sono stati descritti dal premio Nobel De Gennes attraverso il così detto “reptation model”.
Nonostante ciò, adesso sappiamo che l’entropia non è un concetto così lontano dalla vita di tutti i giorni e la prossima volta che ci verrà chiesto da qualcuno “si ma questo concetto strano che tu chiami entropia alla fine a che serve?” avremo sempre sotto mano un esempio pratico da proporre.
Articolo a cura di Carmine Schiavone.
