Perché il ghiaccio non si forma sempre a 0°C: la “magia” dei liquidi sottoraffreddati

Vi è mai capitato di trovarvi vicino ad un corso d’acqua in pieno inverno e di notare che questo, nonostante la temperatura ben al di sotto dello zero, continuasse a scorrere imperterrito senza il minimo accenno di ghiacciare? Se la risposta è sì e siete delle menti curiose, allora vi starete chiedendo come sia possibile che l’acqua non si ghiacci dato che la sua temperatura di solidificazione – come si impara già fin dai primi anni di scuola – corrisponde agli 0 °C. Non vi preoccupate, i vostri insegnanti non vi hanno mentito, più semplicemente hanno omesso una parte della spiegazione per non complicare troppo le cose.
Dovete sapere, infatti, che la temperatura dell’acqua – ma lo stesso concetto vale per le sostanze in generale – non è l’unica condizione necessaria affinché avvenga la solidificazione. Ciò può essere verificato semplicemente mettendo una bottiglietta d’acqua (più pura l’acqua meglio è) nel freezer per qualche ora affinché il liquido raggiunga la temperatura del congelatore (tipicamente intorno ai -18/-20 °C). Una volta estratta con cura la bottiglietta vedrete che l’acqua non si sarà ghiacciata nonostante la bassa temperatura, ma se colpite con forza la bottiglia oppure se provate a versare l’acqua accade una cosa incredibile: l’acqua ghiaccia improvvisamente! È magia questa? In un certo senso sì, tanto è vero che molti illusionisti sfruttano questo fenomeno fisico per ammaliare i propri spettatori. In realtà, però, si tratta di Scienza e nei prossimi paragrafi cercheremo di darvene la spiegazione.
Acqua e ghiaccio a confronto
L’acqua e il ghiaccio sono due diverse “forme” della stessa sostanza, ovvero quella molecola composta da due atomi di idrogeno e uno di ossigeno (H2O) che noi chiamiamo acqua. Per essere più precisi, invece di parlare di “forma” dobbiamo parlare di diversi stati di aggregazione della materia. Infatti, l’acqua – così come tutte le altre sostanze – può trovarsi in diversi stati a dipendenza della temperatura e della pressione: solido, liquido e gassoso. Ma se la sostanza è sempre la stessa, allora dove sta la differenza fra acqua e ghiaccio?
La differenza nei tre stati di aggregazione sta nella libertà con cui le molecole di acqua possono muoversi l’una rispetto l’altra. Nel ghiaccio (stato solido), le molecole d’acqua non si muovono liberamente l’una rispetto all’altra e sono disposte in modo ordinato. Questa struttura ordinata prende il nome di reticolo cristallino. Nell’acqua (stato liquido) le molecole si muovono più o meno liberamente, ma sono comunque sempre influenzate dalle molecole circostanti. Mentre allo stato gassoso le molecole d’acqua sono libere di muoversi nello spazio in modo caotico. La differenza importante fra acqua e ghiaccio, perciò, sta nel fatto che in quest’ultimo le molecole si dispongono a formare una struttura ordinata. Questa, infatti, è la seconda condizione – oltre alla temperatura – per avere la formazione di ghiaccio a partire da acqua allo stato liquido.
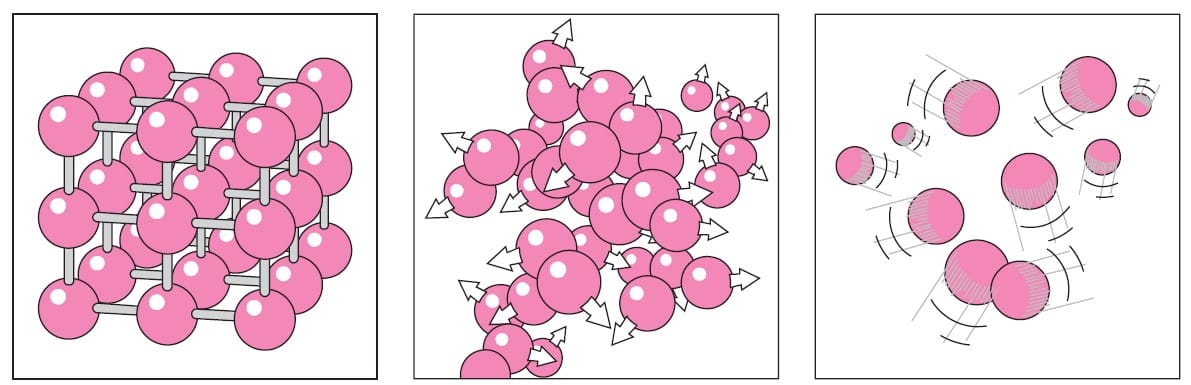
Fonte: Yunus A. Cengel, John M. Cimbala, Meccanica dei Fluidi, McGraw-Hill, 2014
La solidificazione dell’acqua
Il processo di solidificazione dell’acqua a formare ghiaccio – ma lo stesso, ricordiamo, vale in generale per tutte le sostanze – è piuttosto complesso. La solidificazione di un solido cristallino avviene attraverso due fasi: la nucleazione e l’accrescimento. Per spiegare il fenomeno della nucleazione partiamo dal considerare una bottiglia di acqua pura raffreddata al di sotto dei 0°C. Se potessimo guardare il comportamento delle molecole d’acqua con i nostri occhi vedremmo queste cercare continuamente di aggregarsi in dei microscopici cristalli di ghiaccio, detti in gergo tecnico “nuclei”, per poi dissolversi.
Ad un certo punto però, dopo aver colpito con forza la bottiglia, vedremmo alcuni di questi microscopici cristalli di ghiaccio riuscire ad aggregare sufficienti molecole d’acqua tali da raggiungere una dimensione critica – parliamo sempre di grandezze molto piccole – che ne evita il dissolvimento, perciò, i nuclei possono continuare a crescere fino a ghiacciare l’intera bottiglia. Il fatto che l’acqua nella bottiglia non riesca a ghiacciare anche se sottozero è dovuto proprio all’impossibilità delle molecole d’acqua di formare la struttura ordinata di cui parlavamo sopra.
Questo interessante fenomeno fisico prende il nome di nucleazione omogenea e avviene a causa di una competizione fra l’energia aggiuntiva che il nucleo accumula aumentando la propria superficie e la riduzione di energia dovuta all’aumentare del suo volume. Dovete sapere, infatti, che la superficie per un solido rappresenta una regione ad alta energia, mentre le molecole (o atomi) al suo interno si trovano ad uno stato energetico più basso.
Lo stesso principio è facilmente visibile nei liquidi, in particolare, osservando una goccia di rugiada si nota che questa tende ad assumere naturalmente una forma sferica, proprio perché la sfera è la forma geometrica che presenta la minor superficie dato un certo volume. In questo modo le gocce di rugiada riescono a minimizzare la propria energia. La Natura, infatti, è “tirchia” e predilige sempre i sistemi a bassa energia. Altra cosa interessante di questo fenomeno è che il raggio critico del nucleo diventa più piccolo al diminuire della temperatura. Ciò significa che esiste un limite alla temperatura a cui si può raffreddare l’acqua della nostra bottiglia senza che questa ghiacci, ovvero -48 °C.

Le superfici facilitano la solidificazione
Tornando al discorso dei corsi d’acqua, vi sarà sicuramente capitato di notare che il ghiaccio comincia sempre a formarsi a partire dalla riva oppure in prossimità di ramoscelli o altri detriti. Ciò accade perché la presenza di una superficie preesistente – quella della riva di un fiumiciattolo per esempio – favorisce la nucleazione dei cristalli di ghiaccio riducendo l’effetto dell’energia ritardante. Questo meccanismo prende il nome di nucleazione eterogenea ed è di fatto il modo in cui tutte le sostanze solidificano in natura dato che è statisticamente molto più probabile avere un liquido che presenta delle impurità rispetto ad uno molto puro, il quale solitamente deve essere ottenuto tramite processi di purificazione.

Se prendete, ad esempio, una bottiglietta riempita con acqua di rubinetto e provate a metterla in freezer per abbassare la sua temperatura sottozero, nella maggior parte dei casi l’acqua ghiaccerà già intorno agli 0 °C. Questo succede perché le microscopiche impurità solide all’interno dell’acqua mettono a disposizione la propria superficie per formare i nuclei di ghiaccio. Tutte le impurità che facilitano la solidificazione di un liquido tramite il meccanismo appena descritto vengono chiamate in gergo tecnico “agenti nucleanti”. Nel mondo industriale si fa un uso pratico degli agenti nucleanti, per esempio nell’industria siderurgica vengono utilizzati per raffinare la microstruttura dei prodotti ottenuti tramite fusione.
Articolo a cura di Axel Baruscotti
